İmmünglobülinlerin yapısı
İmmünglobülinler, B lenfositler antijen tarafından uyarıldığında farklılaşmaya başlar ve sonunda antikor veya immünglobülin üretir. Immünglobülinler kanın serum bölümünde bulunan glikoproteinlerdir. Yapılarında %82-96 oranında polipeptid (%2-14 oranında karbonhidrat) içerirler. Elektroforez yapıldığında elektroforez özelliği birbirinden hafif farklı olan beş sınıf ortaya çıkar: IgG, IgM, IgA, IgD ve IgE. Ig’ler immün sistemin hümoral bölümünde yer alır ve opsonizasyonda veya kompleman aktivasyonunda rol oynar. Her Ig sınıfının kendine ait özellikleri olmasına rağmen bazı özellikleri de ortaktır.
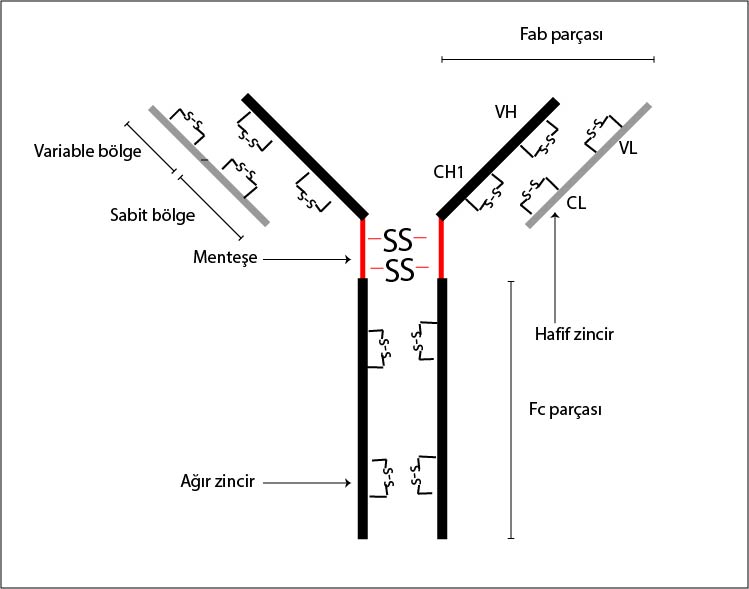
İmmünglobulinler temelde benzer yapı gösterirler ve bir Ig molekülü "monomer" adı da verilen en az bir temel birim'den oluşmuştur. Bir Ig molekülü elektron mikroskopta incelendiğinde Y harfi şeklinde görülür. Ig'ler globulin yapısında protein olduklarına göre, polipeptid zincirlerinden meydana gelmişlerdir. Monomer (= bir temel birim) den oluşan IgG molekülünde iki çeşit polipeptid zinciri vardır ve her bir çeşitten ikişer adet bulunmaktadır.
Hafif zincir = L zinciri (L = Light = Hafif) : Molekül ağırlığı daha az olan kısa zincirlerdir. K (kappa) ve (lambda) olmak üzere iki tipi vardır. Her iki tip L zinciri de tüm Ig çeşitlerinde bulunabilir. Ancak bir Ig molekülündeki iki kısa zincirin tipi aynıdır ve birbirine özdeştir, biri diğerinden farklı olmaz. Bir antikor molekülünde her iki tip L zinciri beraber bulunmaz.
Ağır zincir = H zinciri (H = Heavy = Ağır) : Molekül ağırlığı fazla olan, uzun zincirlerdir. Beş Ig çeşidinin de H zincirleri birbirinden farklı yapıdadır. Bunlar sırasıyla şöyle isimlendirilir.
- IgG / (gamma) H zinciri
- IgM / μ (mü) H zinciri
- IgA / (alfa) H zinciri
- IgD / (delta) H zinciri
- IgE / (epsilon) H zinciri
Ig molekülünde hafif zincirler Y harfi şeklindeki molekülün kol kısımlarında, ağır zincirler ise hem kol, hem de gövde kısmında bulunurlar. Kollarda hafif ve ağır zincir arasında, gövdede ise iki ağır zincir arasında bulunan disülfid bağları, polipeptid zincirleri bir arada tutarak Ig molekülünü oluştururlar. H ve L zincirlerinde her polipeptid zincirinde olduğu gibi NH2 ile sonlanan bir aminoterminal uç ve COOH ile sonlanan karboksiterminal uç bulunur. Ig molekülünde Y harfinin iki kolunun uç kısımları aminoterminal uçlardır ve antijenler bu kısımlara bağlanır. H ve L zincirlerinin aminoterminal uca yakın olan kısımlarındaki aminoasitlerin diziliş sırası değişebilir özel- likte olduğundan bu bölgelere V Bölgesi (= Variable = değişken) adı verilir. Bu değişken kısımlar Ig molekülünün (yani antikorun) oluşumuna neden olan antijen molekülüne uyacak özellikte sentezlenirler. Polipeptid zincirlerinin geri kalan kısımlarında değişkenlik görülme- diğinden bu kısımlara C bölgesi (= Constant = Değişmez) adı verilir.